اسید سنج | PH متر چیست | PH Meter
اسید سنج یا PH متر چیست؟ PH Meter
اسید سنج و یا PH متر دستگاهی است که به منظور اندازه گیری میزان اسیدی یا قلیایی بودن مایعات بکار می رود. PH واژه ای است که جهت تعریف میزان یون های معادل هیدروژن موجود در محلول استفاده می شود. اندازه گیری میزان اسیدی بودن مایعات در بسیاری از صنایع از قبیل صنایع غذایی ، دارویی ، صنایع کشاورزی و دامپروری ، تصفیه خانه ها ، آزمایشگاه های صنعتی و پزشکی و در سایر صنایع که اندازه گیری میزان اسید آن مورد نیاز باشد مورد استفاده قرار می گیرد.
خرید دستگاه اسید سنج :
| {product 1453|name|cart|picture|link|border|pricedis3|pricetax1} | {product 153329|name|cart|picture|link|border|pricedis3|pricetax1} | {product 1451|name|cart|picture|link|border|pricedis3|pricetax1} | {product 1819|name|cart|picture|link|border|pricedis3|pricetax1} |
تعریف ph سنج :
PH از لغت فرانسوی Hydrogene گرفته شده ، اصطلاح ph که مخفف دو کلمه Hydrogene و power است بیانگر قدرت یونی هیدروژن در آب می باشد به عبارت دیگر نسبت مولوکول های یونیزه شده به غیر یونیزه شده در محیط های آبی را pH می گویند. در واقع درصد اسیدیته و قلیائیت آب را pH میگوییم .درجه اسیدیته یا قلیائیت آب بین صفر و۱۴ متغیر است و عدد ۷ که حد وسط آن می باشد به معنی نقطه مرزی یا خنثی می باشد که به معنی این است که نه آب اسیدی است نه قلیایی.
اگر هر چه از طرف عدد خنثی یعنی ۷ به طرف صفر حرکت کنیم آب به سمت اسیدی کشیده شده و به معنی کاهش pH است و هر چه از عدد خنثی یعنی ۷ به سمت ۱۴ حرکت کنیم آب به سمت قلیایی و افزایش pH حرکت می کند. با اینکه ممکن است یون های مختلفی در محلول شکل بگیرند، ولی آنهایی که تعیین می کنند محلول اسیدی یا قلیائی است، به ترتیب یون هیدروژن (H+) و یون هیدروکسیل (OH-) هستند. زمانی که تعداد یون های هیدروژن از تعداد یون های هیدروکسیل در محلول بیشتر باشد، محلول اسیدی است. وقتیکه تعداد این دو یون برابر باشد، محلول خنثی است. زمانی که تعداد یون های هیدروژن از تعداد یونهای هیدروکسیل در محلول کمتر باشد، محلول قلیایی (بازی) است.
میزان تشکیل یون در محلول، برای اسیدها و قلیاها متفاوت است. آن دستهای که تقریباً بهطور کامل یونیزه میشوند، اسید یا باز قوی هستند. هیدرو کلرید اسید و سدیم هیدروکسیل مثالهایی برای این دسته اند. بقیه اسیدها و بازهای به مقدار کمی یونیزه میشوند و اسید یا باز ضعیف هستند. استیک اسید و آمونیوم هیدروکسیل نمونه هایی برای این گروه می باشند. می توان اسیدها و بازها را بنا بر تعداد یون هیدروژنی که در هر مولکول میتوانند از دست دهند، دستهبندی کرد. اگر اسیدی در هر مولکولش فقط یک یون هیدروژن آزاد کند، به آن اسید تک ظرفیتی می گویند.
حتی آب خالص نیز به مقدار خیلی کم به یون هیدروژن و هیدروکسیل تبدیل میشود. در دمای 25 درجه سانتیگراد، آب خالص همواره دارای 0.0000001 یا 1×10-7 گرم اکی والان در لیتر یون هیدروژن دارد و چون آب خالص خنثی است به همین میزان یون هیدروکسیل نیز دارد. حاصلضرب این دو غلظت برابر با مقدار ثابت 1.0×10-7 در 25 درجه سانتیگراد است. اگر غلظت یون هیدروژن یک محلول 1.0×10-4 گرم اکی والان در لیتر باشد، غلظت یون هیدروکسیل در این محلول برابر 1.0×10-10 گرم اکی والان در لیتر خواهد بود. چون در این مورد غلظت یون هیدروژن بیشتر از غلظت یون هیدروکسیل است، محلول اسیدی است.
برای سادهتر بیان کردن غلظت یون هیدروژن، بهجای بیان آن با اعداد اعشاری و توانهای منفی، مفهوم PH تعریفشده است. بیان ریاضی این مفهوم، برابر با منفی لگاریتم غلظت یون هیدروژن در مبنای 10 است. محلولی با غلظت یون هیدروژن برابر 1.0×10-7 گرم اکی والان در لیتر PH برابر 7 دارد.
برخی از اسیدسنج های موجود در فروشگاه:
| {product 1825|name|cart|picture|link|border|pricedis3|pricetax1} | {product 1800|name|cart|picture|link|border|pricedis3|pricetax1} | {product 1821|name|cart|picture|link|border|pricedis3|pricetax1} |
| برای مشاهده لیست کامل اسیدسنج های موجود در سایت اینجا کلیک نمایید. | ||
ازآنجاییکه در محلول های اسیدی غلظت یون هیدروژن بیشتر از 1.0×10-7 گرم اکی والان در لیتر است، مقدار PH آنها کمتر از 7 است. بلعکس محلولهای قلیایی PH بالاتر از 7 دارند.
مهم است که به یاد داشته باشید، تغییر یک واحد در PH برابر با 10 برابر تغییر در اسیدیته یا قلیایی بودن محلول است؛ بنابراین یک محلول با PH=4 در مقایسه با محلولی با PH=5، 10 برابر اسیدی تر است، محلولی با PH=3 در برابر محلولی با PH=5، 100 برابر اسیدی تر است و محلولی با PH=2 در برابر محلولی با PH=5، 1000 برابر اسیدی تر است. محدوده پذیرفته شده برای تغییرات PH از 0 تا 14 است.
روش های مختلف اندازه گیری PH
اندازه گیری دقیق تر pH با یک متر الکترونیکی pH بدست می آید. یک سیستم اندازه گیری pH از سه بخش تشکیل شده است: یک الکترود اندازه گیری pH ، یک الکترود مرجع و یک متر با امپدانس ورودی بالا. الکترود pH را می توان به عنوان یک باتری ، با ولتاژ که با pH محلول اندازه گیری شده متفاوت است ، تصور کرد. الکترود اندازه گیری pH یک لامپ شیشه ای حساس به یون هیدروژن است ، با یک خروجی میلی ولت که با تغییر در غلظت یون نسبی هیدروژن در داخل و خارج از لامپ متفاوت است. خروجی الکترود مرجع با فعالیت یون هیدروژن متفاوت نیست. الکترود pH از مقاومت داخلی بسیار بالایی برخوردار است و باعث می شود اندازه گیری ولتاژ با pH دشوار باشد. امپدانس ورودی pH متر و مقاومت نشت از این رو فاکتور های مهم است. pH سنج در اصل تقویت کننده امپدانس بالایی است که ولتاژ دقیقه الکترود دقیق را اندازه گیری می کند و نتایج را مستقیماً در واحدهای pH بر روی صفحه نمایش آنالوگ یا دیجیتال نمایش می دهد. در بعضی موارد ، ولتاژها را می توان برای برنامه های خاص یا برای استفاده با الکترود های یون-انتخابی یا اکسیداسیون-کاهش پتانسیل (ORP) نیز خواند.
دو روش کلی برای سنجش میزان PH در آب ها وجود دارد که شامل دو روش زیر است.
1- روش استفاده از PH متر الکتریکی
2- تعیین PH به روش رنگ سنجی
1- روش استفاده از PH متر الکتریکی:
اکثر اندازه گیری های PH در آزمایشگاه با استفاده از PH متر به وسیله یک مدار الکتریکی کار می کند. این مدار از یک الکترود شیشه ای و یک الکترود مرجع خارجی و یک ولت متر که پتانسیل الکتریکی را در مدار ثبت می کند، تشکیل شده است. الکترود شیشه ای از یک سیم حامل جریان تشکیل شده است که در داخل یک محلول که PH مشخص دارد فرو برده شود.
2-PH متری به روش رنگ سنجی:
این روش شیمیایی که برای تعیین PH استفاده می شود، افزودن یک قطره از یک اندیکاتور اسید – باز به نمونه است. کاغذهای PH اندیکاتور مناسب برای این کار هستند. یک قطره از نمونه روی کاغذ PH قرار داده می شود و این ترتیب رنگ مورد نظر مشاهده می شود. اندیکاتورها مولکول های بزرگ آلی هستند که بر اساس PH محلول تغییر رنگ پیدا می کنند. در محدوده ای از دامنه PH برای هر اندیکاتور تغییر رنگ مشاهده می شود. (معمولا حدود 5/1 واحد PH ( PHهای متوسط در میانه جدول مشاهده می شوند که بر اساس این مقدار PH رنگ های بینابینی نیز در این محدوده ی PH قرار می گیرند
به عنوان مثال : اندیکاتور کروزول قرمز در PH پایین تر از 7 ،رنگ محلول اندیکاتور زرد است و در PH بالاتر از 8/8 رنگ محلول قرمز رنگ است. در مقادیر PH متوسط براساس نوع PH تغییر درجه رنگ محلول به صورت نارنجی خواهد بود.
اندیکاتورهای مختلف زیادی وجود دارند که می توانند تمام محدوده ی PH را تحت پوشش قرار دهند.
کالیبره کردن PH متر
قبل از استفاده از دستگاه PH متر باید دستگاه کالیبره شود. محلول های بافری با PH های معلوم برای چنین کاری مناسب هستند.
دستگاه PH متر را روشن می کنیم، الکترود را با آب مقطر می شوییم . آن را تکان می دهیم تا خشک شود. سپس آن را درون بشری که حاوی محلول بافری با PH 7 است قرار می دهیم صبر می کنیم تا عدد روی صفحه نمایش ثابت شود. الکترود را با آب مقطر می شوییم به خوبی آن را تکان می دهیم تا آب آن گرفته شود. بعد داخل محلول بافر با PH 4 قرار می دهیم تا PH متر به حالت ثبات قرار گیرد.
کالیبره کردن دستگاه را از طریق اندازه گیری در PH استاندارد 7 کنترل می نماییم. برای انجام این کار الکترود باید در داخل محلول قرار گیرد.در این مرحله PH متر آماده است.
در این مرحله مقدار کافی از نمونه را داخل بشر 100 میلی لیتر می ریزیم و الکترود را داخل آن غوطه ور می کنیم و می گذاریم حدود 2 دقیقه دستگاه به حالت ثبات نماند، وقتی عدد روی دستگاه ثابت شد از روی صفحه نمایش مقدار PH نمونه مورد نظر را می خوانیم.
کاربرد انواع اسید سنج ها
اسید سنج های مختلف برای کاربرد های مختلف طراحی گردیده اند که دو نوع بسیار رایج مدل های پرتابل و مدل های قابل نصب هستند. مدل های پرتابل بیشتر مصارف آزمایشگاهی دارد ولی نمونه های قابل نصب با خروجی پیوسته اطلاعات و میزان PH را در هر لحظه مانیتور میکند .در مواردی که اندازه گیری به صورت پیوسته مد نظر است باید از ترانسمیتر PH متناسب استفاده کرد و میزان اسیدی بودن را به صورت همزمان به اتاق کنترل یا مانیتورینگ فرستاد.
به طور کلی از اسید سنج ها در بسیاری از صنایع از قبیل صنایع غذایی،دارویی، صنایع کشاورزی و دامپروری ، تصفیه خانه ها ، آزمایشگاههای صنعتی و پزشکی و در سایر صنایع که اندازه گیری میزان اسید آن مورد نیاز باشد استفاده می شود.
پارامترهای مهم در انتخاب یک اسید سنج
در انتخاب یک اسید سنج باید به موارد زیر توجه داشت:
• دقت اسید سنج
• نوع پراب دستگاه ، کاربرد و نحوه نصب
• طول کابل سنسور ( در مواردی که زیاد باشد نیاز به پری آمپلیفایر یا تقویت کننده داریم )
• داشتن کنترلر و نمایشگر اسید در مدلهای قابل نصب
• رزولوشن دستگاه اندازه گیری
• قابلیت کالیبره کردن
• قابل اتصال به کامپیوتر
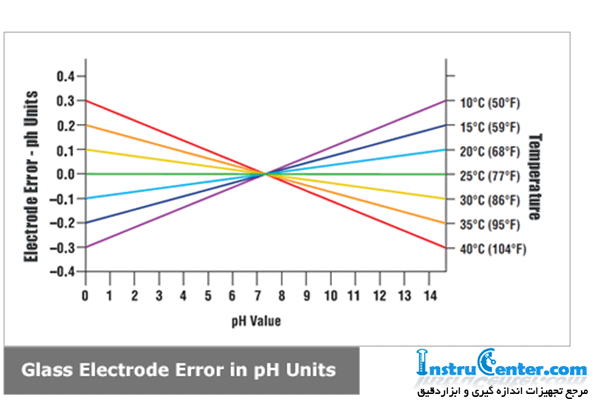
اثر دما بر pH :
درجه حرارت بالاتر از 25 درجه سانتیگراد : جبران دما pH بالا را کاهش می دهد و pH کم را بالا می برد و در نتیجه مقدار آن به خنثی نزدیک می شود. درجه حرارت زیر 25 درجه سانتیگراد : جبران درجه حرارت باعث افزایش pH بالا (اساسی تر) و pH کم (اسیدی تر) می شود ، و در نتیجه مقادیری دورتر از خنثی قرار می گیرد. استفاده از نیاز به جبران دما یا عدم استفاده از آن ، مربوط به دقت pH لازم است. به عنوان مثال ، اگر میزان دقت آن pH 0.1 pH pH باشد ، در pH 6 و درجه حرارت 45 درجه سانتیگراد (113 درجه فارنهایت) ، خطا 0.06 است ، خوب در حد نیازهای دقیق. از طرف دیگر ، با همان میزان دقت pH pH 0.1 ± ، کارکردن در pH 10 و 55 درجه سانتیگراد (131 درجه فارنهایت) خطای 0.27 pH را به همراه دارد و باید از جبران خسارت استفاده کرد.
در صورت نیاز به جبران خسارت می توان از یکی از دو روش انجام داد. اگر دما در نوسان باشد ، باید از جبران ساز اتوماتیک استفاده شود. اگر دما در چند درجه سانتیگراد ثابت باشد ، می توان از جبران ساز دستی استفاده کرد. در صورت عدم نیاز به جبران ساز ، می توان یک مقاومت ثابت در سراسر پایانه های جبران کننده دما نصب کرد. هر یک از دستگاه های فوق – جبران ساز خودکار ، جبران ساز دستی یا مقاومت ثابت – به عنوان تابعی از مدار الکترونیکی pH سنج عمل می کند. به این ترتیب ، اطلاعات و قطعات باید از تولید کننده کنتور بدست آید. در صورت استفاده از جبران ساز های اتوماتیک ، همیشه باید در محل مشابه الکترود pH قرار داشته باشند. هنگامی که الکترودها در بافر کالیبره می شوند ، جبران کننده دما نیز باید در بافر باشد. در یک روش مشابه ، یک جبران ساز دمای دستی باید تنظیم شود تا منعکس کننده دمایی باشد که الکترود pH در طول هر دو کالیبراسیون و عملکرد در معرض آن باشد.
چالش ها در زمان اندازه گیری ph :
مطمئناٌ زمان اندازه گیری ph مشکلاتی برای اندازه گیری به وجود می آید. لیست زیر انواع مشکلی را که می توانید هنگام اندازه گیری pH و نحوه رسیدگی به آنها انتظار داشته باشید نشان می دهد.
– ابزار دقیق اغلب با ایجاد خطای تکرارپذیری ، سر و صدای اندازه گیری یا هیسترزیس دریچه منبع اختلال در سیستم های pH است.
– اگر نقاط تنظیم بر روی اجزای شیب دار منحنی های تیتراسیون باشد ، حلقه های pH درون خط ، بدون در نظر گرفتن حالت های کنترل و تنظیم ، نوسان می کنند.
– مجتمع های فرونشانی الکترود pH با خاتمه غیرقابل انعقاد در زیر سطح مایع در نهایت خاتمه مرطوب دارند.
– دریچه های کنترل کننده معرف که به سیستم تزریق داخل سیستم نزدیک نیستند ، باعث تاخیر در تحویل معرف به اندازه کافی بزرگ برای توصیف ابزارهای کلمات تجاری شما می شوند که ممکن است خارجی به نظر برسند.
شما برای تشخیص مشکلات به یک جریان سنج یا یک هشدار دهنده نیاز دارید.
– سیگنال های جریان مستقیم باید با خروجی های کنترل کننده pH ضرب شوند و برای کار مستقیم شیرهای معرف یا ایجاد نقاط کنترل جریان معرف استفاده شوند.
– تأخیرهای حمل و نقل به الکترودهای pH در خانه های آنالایزر بیش از مهلت های اختلاط خواهد بود – به گونه ای که افزایش راحتی در بررسی الکترودها با کاهش راحتی در بررسی ضبط روند.
– الکترودهای تزریقی باید ترجیح دهند که هر زمان ممکن امکان استفاده از قطعات نگهدارنده را داشته باشند تا مشکلات تعمیر و نگهداری و زمان پاسخگویی را بهبود بخشند – اما همه الکترودهای تزریقی برابر نیستند.
– اگر لازم نیست آنها را کنترل کنید مخازن بزرگ خوب هستند. از حجم بالادست برای کاهش مصرف معرف یا پایین دست برای کاهش خطای کنترل استفاده کنید.




















برای اندازه گیری اسید فیتیک موجود در خمیر نان چه دستگاهی لازم است؟